План:
-
Введение
- 1 Связь между температурой и энергией
- 2 Определение энтропии Примечания
Введение
Постоянная Больцмана (k или k B ) - физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в системе СИ равно
Дж/К .
Числа в круглых скобках указывают стандартную погрешность в последних цифрах значения величины. Постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако, вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний. В естественной системе единиц Планка естественная единица температуры задаётся так, что постоянная Больцмана равна единице.
Универсальная газовая постоянная определяется как произведение постоянной Больцмана на число Авогадро, R = k N A . Газовая постоянная более удобна, когда число частиц задано в молях.
1. Связь между температурой и энергией
В однородном идеальном газе, находящемся при абсолютной температуре T , энергия, приходящаяся на каждую поступательную степень свободы, равна, как следует из распределения Максвелла k T / 2 . При комнатной температуре (300 К) эта энергия составляет Дж, или 0,013 эВ. В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в .
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона. В случае молекулярного газа ситуация усложняется, например двухатомный газ уже имеет приблизительно пять степеней свободы.
2. Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний Z , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
S = k lnZ .Коэффициент пропорциональности k и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими (Z ) и макроскопическими состояниями (S ), выражает центральную идею статистической механики.
Примечания
- 1 2 3 http://physics.nist.gov/cuu/Constants/Table/allascii.txt - physics.nist.gov/cuu/Constants/Table/allascii.txt Fundamental Physical Constants - Complete Listing
Данный реферат составлен на основе статьи из русской Википедии . Синхронизация выполнена 10.07.11 01:04:29
Похожие рефераты:
Постоянная Больцмана, представляющая собой коэффициент, равный k = 1 , 38 · 10 - 23 Д ж К, является частью значительного числа формул в физике. Она получила свое название по имени австрийского физика – одного из основоположников молекулярно-кинетической теории. Сформулируем определение постоянной Больцмана:
Определение 1
Постоянной Больцмана называется физическая постоянная, с помощью которой определяется связь между энергией и температурой.
Не следует путать ее с постоянной Стефана-Больцмана, связанной с излучением энергии абсолютно твердого тела.
Существуют различные методы вычисления данного коэффициента. В рамках этой статьи мы рассмотрим два их них.
Нахождение постоянной Больцмана через уравнение идеального газа
Данная постоянная может быть найдена с помощью уравнения, описывающего состояние идеального газа. Опытным путем можно определить, что нагревание любого газа от T 0 = 273 К до T 1 = 373 К приводит к изменению его давления от p 0 = 1 , 013 · 10 5 П а до p 0 = 1 , 38 · 10 5 П а. Это достаточно простой эксперимент, который может быть проведен даже просто с воздухом. Для измерения температуры при этом нужно использовать термометр, а давления – манометр. При этом важно помнить, что количество молекул в моле любого газа примерно равно 6 · 10 23 , а объем при давлении в 1 а т м равен V = 22 , 4 л. С учетом всех названных параметров можно перейти к вычислению постоянной Больцмана k:
Для этого запишем уравнение дважды, подставив в него параметры состояний.
Зная результат, можем найти значение параметра k:
Нахождение постоянной Больцмана через формулу броуновского движения
Для второго способа вычисления нам также потребуется провести эксперимент. Для него нужно взять небольшое зеркало и подвесить в воздухе с помощью упругой нитки. Допустим, что система зеркало-воздух находится в стабильном состоянии (статическом равновесии). Молекулы воздуха ударяют в зеркало, которое, по сути, ведет себя как броуновская частица. Однако с учетом его подвешенного состояния мы можем наблюдать вращательные колебания вокруг определенной оси, совпадающей с подвесом (вертикально направленной нитью). Теперь направим на поверхность зеркала луч света. Даже при незначительных движениях и поворотах зеркала отражающийся в нем луч будет заметно смещаться. Это дает нам возможность измерить вращательные колебания объекта.
Обозначив модуль кручения как L , момент инерции зеркала по отношению к оси вращения как J , а угол поворота зеркала как φ , можем записать уравнение колебаний следующего вида:
Минус в уравнении связан с направлением момента сил упругости, который стремится вернуть зеркало в равновесное положение. Теперь произведем умножение обеих частей на φ , проинтегрируем результат и получим:
Следующее уравнение является законом сохранения энергии, который будет выполняться для данных колебаний (то есть потенциальная энергия будет переходить в кинетическую и обратно). Мы можем считать эти колебания гармоническими, следовательно:
При выведении одной из формул ранее мы использовали закон равномерного распределения энергии по степеням свободы. Значит, можем записать так:
Как мы уже говорили, угол поворота можно измерить. Так, если температура будет равна приблизительно 290 К, а модуль кручения L ≈ 10 - 15 Н · м; φ ≈ 4 · 10 - 6 , то рассчитать значение нужного нам коэффициента можно так:
Следовательно, зная основы броуновского движения, мы можем найти постоянную Больцмана с помощью измерения макропараметров.
Значение постоянной Больцмана
Значение изучаемого коэффициента состоит в том, что с его помощью можно связать параметры микромира с теми параметрами, что описывают макромир, например, термодинамическую температуру с энергией поступательного движения молекул:
Этот коэффициент входит в уравнения средней энергии молекулы, состояния идеального газа, кинетической теории газа, распределение Больцмана-Максвелла и многие другие. Также постоянная Больцмана необходима для того, чтобы определить энтропию. Она играет важную роль при изучении полупроводников, например, в уравнении, описывающем зависимость электропроводности от температуры.
Пример 1
Условие: вычислите среднюю энергию молекулы газа, состоящего из N -атомных молекул при температуре T , зная, что у молекул возбуждены все степени свободы – вращательные, поступательные, колебательные. Все молекулы считать объемными.
Решение
Энергия равномерно распределяется по степеням свободы на каждую ее степень, значит, на эти степени будет приходиться одинаковая кинетическая энергия. Она будет равна ε i = 1 2 k T . Тогда для вычисления средней энергии мы можем использовать формулу:
ε = i 2 k T , где i = m p o s t + m υ r + 2 m k o l представляет собой сумму поступательных вращательных степеней свободы. Буквой k обозначена постоянная Больцмана.
Переходим к определению количества степеней свободы молекулы:
m p o s t = 3 , m υ r = 3 , значит, m k o l = 3 N - 6 .
i = 6 + 6 N - 12 = 6 N - 6 ; ε = 6 N - 6 2 k T = 3 N - 3 k T .
Ответ: при данных условиях средняя энергия молекулы будет равна ε = 3 N - 3 k T .
Пример 2
Условие: есть смесь двух идеальных газов, плотность которых в нормальных условиях равна p. Определите, какова будет концентрация одного газа в смеси при условии, что мы знаем молярные массы обоих газов μ 1 , μ 2 .
Решение
Сначала вычислим общую массу смеси.
m = ρ V = N 1 m 01 + N 2 m 02 = n 1 V m 01 + n 2 V m 02 → ρ = n 1 m 01 + n 2 m 02 .
Параметр m 01 обозначает массу молекулы одного газа, m 02 – массу молекулы другого, n 2 – концентрацию молекул одного газа, n 2 – концентрацию второго. Плотность смеси равна ρ .
Теперь из данного уравнения выразим концентрацию первого газа:
n 1 = ρ - n 2 m 02 m 01 ; n 2 = n - n 1 → n 1 = ρ - (n - n 1) m 02 m 01 → n 1 = ρ - n m 02 + n 1 m 02 m 01 → n 1 m 01 - n 1 m 02 = ρ - n m 02 → n 1 (m 01 - m 02) = ρ - n m 02 .
p = n k T → n = p k T .
Подставим полученное равнее значение:
n 1 (m 01 - m 02) = ρ - p k T m 02 → n 1 = ρ - p k T m 02 (m 01 - m 02) .
Поскольку молярные массы газов нам известны, мы можем найти массы молекул первого и второго газа:
m 01 = μ 1 N A , m 02 = μ 2 N A .
Также мы знаем, что смесь газов находится в нормальных условиях, т.е. давление равно 1 а т м, а температура 290 К. Значит, мы можем считать задачу решенной.
Если вы заметили ошибку в тексте, пожалуйста, выделите её и нажмите Ctrl+Enter
Определяющая связь между температурой и энергией . Названа в честь австрийского физика Людвига Больцмана , сделавшего большой вклад в статистическую физику , в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно:
Дж / .Числа в круглых скобках указывают стандартную погрешность в последних цифрах значения величины. Постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний. В естественной системе единиц Планка естественная единица температуры задаётся так, что постоянная Больцмана равна единице.
Связь между температурой и энергией
В однородном идеальном газе , находящемся при абсолютной температуре , энергия, приходящаяся на каждую поступательную степень свободы , равна, как следует из распределения Максвелла, . При комнатной температуре (300 ) эта энергия составляет Дж , или 0,013 эВ . В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в .
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона . В случае молекулярного газа ситуация усложняется, например, двухатомный газ имеет приблизительно пять степеней свободы.
Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
Коэффициент пропорциональности и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими () и макроскопическими состояниями (), выражает центральную идею статистической механики.
См. также
Примечания
Wikimedia Foundation . 2010 .
Смотреть что такое "Постоянная Больцмана" в других словарях:
- (обозначение k), отношение универсальной ГАЗОВОЙ постоянной к ЧИСЛУ АВОГАДРО, равное 1,381.10 23 джоулей на градус Кельвина. Оно указывает на взаимосвязь между кинетической энергией частицы газа (атома или молекулы) и ее абсолютной температурой.… … Научно-технический энциклопедический словарь
постоянная Больцмана - — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN Boltzmann constant … Справочник технического переводчика
Постоянная Больцмана - Boltzmann Constant Постоянная Больцмана Физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная … Толковый англо-русский словарь по нанотехнологии. - М.
постоянная Больцмана - Bolcmano konstanta statusas T sritis fizika atitikmenys: angl. Boltzmann constant vok. Boltzmann Konstante, f; Boltzmannsche Konstante, f rus. постоянная Больцмана, f pranc. constante de Boltzmann, f … Fizikos terminų žodynas
Соотношение S k lnW между энтропией S и термодинамической вероятностью W (k постоянная Больцмана). На Больцмана принципе основано статистическое истолкование второго начала термодинамики: природные процессы стремятся перевести термодинамическую… …
- (Максвелла Больцмана распределение) равновесное распределение частиц идеального газа по энергиям (E) во внешнем силовом поле (напр., в поле тяготения); определяется функцией распределения f e E/kT, где E сумма кинетической и потенциальной энергий … Большой Энциклопедический словарь
Не следует путать с постоянной Больцмана. Постоянная Стефана Больцмана (также постоянная Стефана), физическая постоянная, являющаяся постоянной пропорциональности в законе Стефана Больцмана: полная энергия, излучаемая единицей площади … Википедия
Значение постоянной Размерность 1,380 6504(24)×10−23 Дж·К−1 8,617 343(15)×10−5 эВ·К−1 1,3807×10−16 эрг·К−1 Постоянная Больцмана (k или kb) физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского… … Википедия
Статистически равновесная функция распределения по импульсам и координатам частиц идеального газа, молекулы к рого подчиняются классич. механике, во внешнем потенциальном поле: Здесь постоянная Больцмана (универсальная постоянная), абсолютная… … Математическая энциклопедия
Книги
- Вселенная и физика без "темной энергии" (открытия, идеи, гипотезы). В 2 томах. Том 1 , О. Г. Смирнов. Книги посвящены проблемам физики и астрономии, существующим в науке десятки и сотни лет от Г. Галилея, И. Ньютона, А. Эйнштейна до наших дней. Мельчайшие частицы материи и планеты, звезды и…
Согласно закону Стефана – Больцмана плотность интегрального полусферического излучения E 0 зависит только от температуры и изменяется пропорционально четвертой степени абсолютной температуры T :
Стефана – Больцмана постоянная σ 0 – физическая постоянная, входящая в закон, определяющий объемную плотность равновесного теплового излучения абсолютно черного тела:

Исторически закон Стефана-Больцмана был сформулирован раньше закона излучения Планка, из которого он вытекает как следствие. Закон Планка устанавливает зависимость спектральной плотности потока излучения E 0 от длины волны λ и температуры T :

где λ – длина волны, м; с
=2,998 10 8 м/с – скорость
света в вакууме; Т
– температура тела, К;
h
= 6,625 ×10 -34 Дж×с– постоянная Планка.
Физическая постоянная k , равная отношению универсальной газовой постоянной R =8314Дж/(кг× K) к числу Авогадро NA =6,022× 10 26 1/(кг× моль):

Число различных конфигураций системы из N частиц для данного набора чисел n i (число частиц, находящихся в i -том состоянии, которому соответствует энергия e i ) пропорционально величине:

Величина W есть число способов распределения N частиц по энергетическим уровням. Если справедливо соотношение (6) то считается, что исходная система подчиняется статистике Больцмана. Набор чисел n i , при котором число W максимально, встречается наиболее часто и соответствует наиболее вероятному распределению.
Физическая кинетика – микроскопическая теория процессов в статистически неравновесных системах.
Описание большого числа частиц может успешно осуществляться вероятностными методами. Для одноатомного газа состояние совокупности молекул определяется их координатами и значениями проекций скоростей на соответствующие координатные оси. Математически это описывается функцией распределения, характеризующей вероятность пребывания частицы в данном состоянии:

есть ожидаемое число молекул в объеме d d , координаты которых находятся в интервале от до +d , а скорости в интервале от до +d.
Если осредненной по времени потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией, то газ называется идеальным. Идеальный газ называется газом Больцмана, если отношение длины пробега молекул в этом газе к характерному размеру течения L конечно, т.е.

т.к. длина пробега обратно пропорциональна nd 2 (n – числовая плотность 1/м 3 , d – диаметр молекулы, м).
Величину
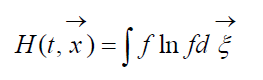
называют H -функцией Больцмана для единицы объема, которая связана с вероятностью обнаружения системы из молекул газа в данном состоянии. Каждому состоянию соответствуют определенные числа заполнения шестимерных пространственно-скоростных ячеек, на которые может быть разбито фазовое пространство рассматриваемых молекул. Обозначим W вероятность того, что в первой ячейке рассматриваемого пространства окажется N 1 молекул, во второй N 2 и т.д.
С точностью до постоянной, определяющей начало отсчета вероятности, правомерно соотношение:
 ,
,
где  – H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.
– H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.

Больцмана принцип устанавливает связь между энтропией S физической системы и термодинамической вероятностью W её состояния:

(печатается по изданию: Коган М.Н. Динамика разреженного газа. – М.: Наука, 1967.)
Общий вид КУБ:

где – массовая сила, обусловленная наличием различных полей (гравитационного, электрического, магнитного), действующая на молекулу; J – интеграл столкновений. Именно этот член уравнения Больцмана учитывает столкновения молекул друг с другом и соответствующие изменения скоростей взаимодействующих частиц. Интеграл столкновений представляет собой пятимерный интеграл и имеет следующую структуру:

Уравнение (12) с интегралом (13) получено для столкновения молекул, при которых не возникает тангенциальных сил, т.е. сталкивающиеся частицы считаются идеально гладкими.
В процессе
взаимодействия внутренняя энергия молекул не меняется, т.е. предполагается, что
эти молекулы являются идеально упругими. Рассматриваются две группы молекул,
имеющих до соударения друг с другом (столкновения) скорости и (рис. 1), а после
столкновения соответственно скорости и . Разность скоростей и называется
относительной скоростью, т.е. . Ясно, что для гладкого упругого
столкновения .
Функции распределения f 1 ", f", f 1 ,f
описывают
молекулы соответствующих групп после и до столкновений, т.е. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Рис. 1. Столкновение двух молекул.
В (13) входят два параметра, характеризующие расположение сталкивающихся молекул друг относительно друга: b и ε; b – прицельное расстояние, т.е. наименьшее расстояние, на которое сблизились бы молекулы при отсутствии взаимодействия (рис. 2); ε называют угловым параметром столкновений (рис. 3). Интегрирование по b от 0 до ¥ и по от 0 до 2p (два внешних интеграла в (12)) охватывает всю плоскость силового взаимодействия перпендикулярно вектору

Рис. 2. Траектория движения молекул.

Рис. 3. Рассмотрение взаимодействия молекул в цилиндрической системе координат: z , b , ε
Кинетическое уравнение Больцмана выведено при следующих допущениях и предположениях.
1. Считается, что происходит в основном столкновения двух молекул, т.е. роль столкновений одновременно трех и большего числа молекул незначительна. Это допущение позволяет использовать для анализа одночастичную функцию распределения, которая выше названа просто функцией распределения. Учет столкновения трех молекул приводит к необходимости использования в исследовании двухчастичной функции распределения. Соответственно анализ существенно усложняется.
2. Предположение о молекулярном хаосе. Оно выражается в том, что вероятности обнаружения частицы 1 в фазовой точке и частицы 2 в фазовой точке независимы друг от друга.
3.
Равновероятны столкновения молекул с любым прицельным расстоянием, т.е. функция
распределения не меняется на диаметре взаимодействия. Необходимо отметить, что
анализируемый элемент должен быть малым, чтобы f
в пределах этого элемента не менялась, но в то же время
чтобы
не была велика относительная флуктуация ~
. Потенциалы
взаимодействия, используемые при вычислении интеграла столкновений, являются
сферически симметричными, т.е. ![]() .
.
Распределение Максвелла-Больцмана
Равновесное состояние газа описывается абсолютным Максвелловским распределением, которое является точным решением кинетического уравнения Больцмана:

где m – масса молекулы, кг.
Общее локально-максвелловское распределение иначе называемое распределение Максвелла-Больцмана:

в том случае, когда газ движется
как целое со скоростью и переменные n
,
T
зависят от координаты
и времени t
.
В поле тяготения Земли точное решение уравнения Больцмана показывает:
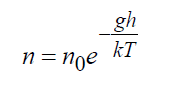
где n 0 = плотность у поверхности Земли, 1/м 3 ; g – ускорение силы тяжести, м/с 2 ; h – высота, м. Формула (16) является точным решением кинетического уравнения Больцман либо в безграничном пространстве, либо при наличии границ, не нарушающих этого распределения, при этом температура также должна оставаться постоянной.
Эта страница оформлена Пузиной Ю.Ю. при поддержке Российского Фонда Фундаментальных Исследований – проект №08-08-00638.
Для постоянной, связанной с энергией излучения чёрного тела, смотри Постоянная Стефана-Больцмана
|
Значение постоянной k |
Размерность |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
Смотри также Значения в различных единицах ниже. |
|
Постоянная Больцмана (k или k B ) - физическая постоянная, определяющая связь между температурой вещества и энергией теплового движения частиц этого вещества. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в системе СИ равно
В таблице последние цифры в круглых скобках указывают стандартную погрешность значения постоянной. В принципе, постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако точное вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний.
Экспериментально постоянную Больцмана можно определить с помощью закона теплового излучения Планка, описывающего распределение энергии в спектре равновесного излучения при определённой температуре излучающего тела, а также другими методами.
Существует связь между универсальной газовой постоянной и числом Авогадро , из которой следует значение постоянной Больцмана:
Размерность постоянной Больцмана такая же, как и у энтропии.
|
История
В 1877 г. Больцман впервые связал между собой энтропию и вероятность, однако достаточно точное значение постоянной k как коэффициента связи в формуле для энтропии появилось лишь в трудах М. Планка. При выводе закона излучения чёрного тела Планк в 1900–1901 гг. для постоянной Больцмана нашёл значение 1,346 10 −23 Дж/K, почти на 2,5% меньше принятого в настоящее время.
До 1900 г. соотношения, которые сейчас записываются с постоянной Больцмана, писались с помощью газовой постоянной R , а вместо средней энергии на одну молекулу использовалась общая энергия вещества. Лаконичная формула вида S = k log W на бюсте Больцмана стала таковой благодаря Планку. В своей нобелевской лекции в 1920 г. Планк писал:
Эта константа часто называется постоянной Больцмана, хотя, насколько я знаю, сам Больцман никогда не вводил её - странное состояние дел, при том, что в высказываниях Больцмана не было речи о точном измерении этой константы.
Такая ситуация может быть объяснена проведением в то время научных дебатов по выяснению сущности атомного строения вещества. Во второй половине 19 века существовали значительные разногласия в отношении того, являются ли атомы и молекулы реальными, либо они лишь удобный способ описания явлений. Не было единства и в том, являются ли "химические молекулы", различаемые по их атомной массе, теми же самыми молекулами, что и в кинетической теории. Далее в нобелевской лекции Планка можно найти следующее:
«Ничто не может лучше продемонстрировать положительную и ускоряющуюся скорость прогресса, чем искусство эксперимента за последние двадцать лет, когда было открыто сразу множество методов измерения массы молекул практически с той же точностью, что и измерение массы какой-нибудь планеты».
Уравнение состояния идеального газа
Для идеального газа справедлив объединённый газовый закон, связывающий давление P , объём V , количество вещества n в молях, газовую постоянную R и абсолютную температуру T :
В данном равенстве можно сделать замену . Тогда газовый закон будет выражаться через постоянную Больцмана и количество молекул N в объёме газа V :
Связь между температурой и энергией
В однородном идеальном газе, находящемся при абсолютной температуре T
, энергия, приходящаяся на каждую поступательную
степень свободы, равна, как следует из распределения Максвелла, kT
/ 2
. При комнатной температуре
(≈ 300 K) эта энергия составляет ![]() Дж,
или 0,013 эВ.
Дж,
или 0,013 эВ.
Соотношения газовой термодинамики
В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия 3kT / 2 . Это хорошо согласуется с экспериментальными данными. Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню из атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона.
Кинетическая теория даёт формулу для среднего давления P идеального газа:
![]()
Учитывая, что средняя кинетическая энергия прямолинейного движения равна:
![]()
находим уравнение состояния идеального газа:
Это соотношение неплохо выполняется и для молекулярных газов; однако зависимость теплоёмкости изменяется, так как молекулы могут иметь дополнительные внутренние степени свободы по отношению к тем степеням свободы, которые связаны с движением молекул в пространстве. Например, двухатомный газ имеет уже приблизительно пять степеней свободы.
Множитель Больцмана
В общем случае система в равновесии с тепловым резервуаром при температуре T имеет вероятность p занять состояние с энергией E , что может быть записано с помощью соответствующего экспоненциального множителя Больцмана:
![]()
В данном выражении фигурирует величина kT с размерностью энергии.
Вычисление вероятности используется не только для расчётов в кинетической теории идеальных газов, но и в других областях, например в химической кинетике в уравнении Аррениуса.
Роль в статистическом определении энтропии
Основная статья : Термодинамическая энтропия
Энтропия S изолированной термодинамической системы в термодинамическом равновесии определяется через натуральный логарифм от числа различных микросостояний W , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией E ):
![]()
Коэффициент пропорциональности k является постоянной Больцмана. Это выражение, определяющее связь между микроскопическими и макроскопическими состояниями (через W и энтропию S соответственно), выражает центральную идею статистической механики и является главным открытием Больцмана.
В классической термодинамике используется выражение Клаузиуса для энтропии:
![]()
Таким образом, появление постоянной Больцманаk можно рассматривать как следствие связи между термодинамическим и статистическим определениями энтропии.
Энтропию можно выразить в единицах k , что даёт следующее:
В таких единицах энтропия точно соответствует информационной энтропии.
Характерная энергия kT равна количеству теплоты, необходимому для увеличения энтропии S " на один нат.
Роль в физике полупроводников: тепловое напряжение
В отличие от других веществ, в полупроводниках существует сильная зависимость электропроводности от температуры:
где множитель σ 0 достаточно слабо зависит от температуры по сравнению с экспонентой, E A – энергия активации проводимости. Плотность электронов проводимости также экспоненциально зависит от температуры. Для тока через полупроводниковый p-n-переход вместо энергии активации рассматривают характерную энергию данного p-n перехода при температуре T как характерную энергию электрона в электрическом поле:
где q – , а V T есть тепловое напряжение, зависящее от температуры.
Данное соотношение является основой для выражения постоянной Больцмана в единицах эВ∙К −1 . При комнатной температуре (≈ 300 K) значение теплового напряжения порядка 25,85 милливольт ≈ 26 мВ.
В классической теории часто используют формулу, согласно которой эффективная скорость носителей заряда в веществе равна произведению подвижности носителей μ на напряженность электрического поля. В другой формуле плотность потока носителей связывается с коэффициентом диффузии D и с градиентом концентрации носителей n :
![]()
Согласно соотношению Эйнштейна-Смолуховского, коэффициент диффузии связан с подвижностью:
![]()
Постоянная Больцмана k входит также в закон Видемана-Франца, по которому отношение коэффициента теплопроводности к коэффициенту электропроводности в металлах пропорционально температуре и квадрату отношения постоянной Больцмана к электрическому заряду.
Применения в других областях
Для разграничения температурных областей, в которых поведение вещества описывается квантовыми или классическими методами, служит температура Дебая:
![]()
где – , ![]() есть предельная частота упругих
колебаний кристаллической решётки, u
–
скорость звука в твёрдом теле, n
–
концентрация атомов.
есть предельная частота упругих
колебаний кристаллической решётки, u
–
скорость звука в твёрдом теле, n
–
концентрация атомов.


